
被称为“癌王”的胰腺导管腺癌高发神经侵犯,严重影响病人预后及生存质量。外科医生在临床实践中发现,局部神经清扫手术能减少病人术后复发,但其原因及机制尚未清晰。为了描绘胰腺癌的“神经暗网”地图,深圳湾实验室联合北京大学生物医学前沿创新中心、广东省人民医院、昌平实验室、重庆医科大学的研究团队运用前沿的单细胞/单细胞核测序、空间转录组测序手段,结合mIHC、病理形态学分析及体外实验,系统对比不发生神经侵犯与发生神经侵犯的胰腺癌组织,刻画了人胰腺癌组织中神经束的内外微环境,解析了肿瘤相关神经束的具体细胞组分及其与癌细胞、免疫细胞和基质细胞的相互作用,揭示了癌细胞发生神经束侵袭转移(Neural Invasion, NI)的细胞及分子机制。
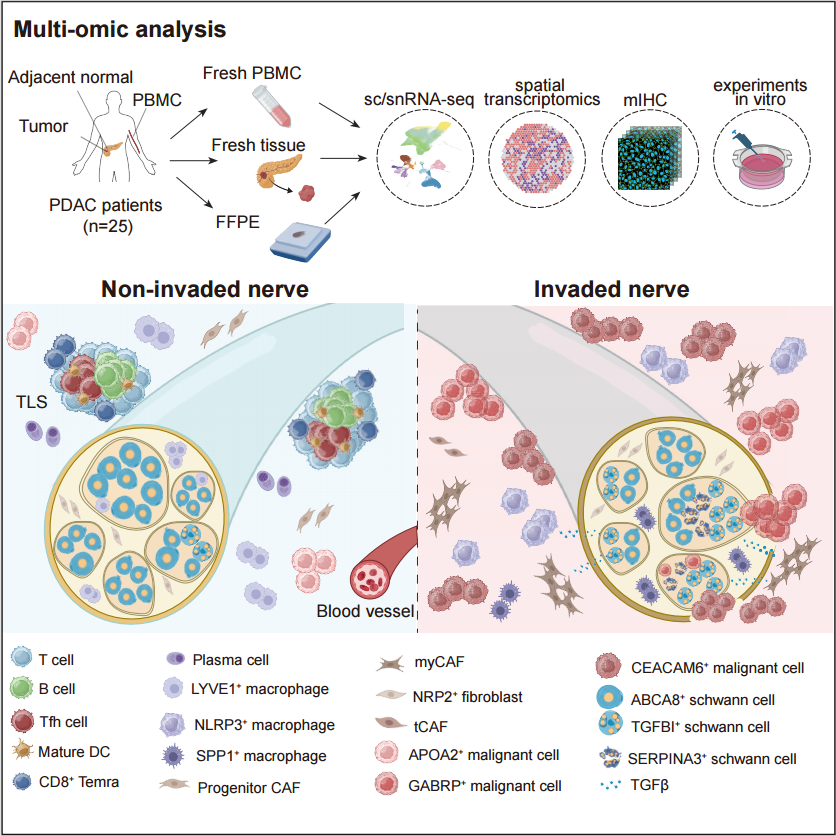
2025年7月17日,该项研究在Cancer Cell杂志在线发表,标题为“Integrated Single-Cell and Spatial Transcriptomics Uncover Distinct Cellular Subtypes Involved in Neural Invasion inPancreatic Cancer”。 研究者对25例胰腺导管腺癌(Pancreatic Ductal Adenocarcinoma, PDAC)患者的62例样本进行了单细胞/单细胞核测序及空间转录组测序,发现低神经侵犯与高神经侵犯的组织有着显著的组成差异。低NI的肿瘤组织中,有更多的终末分化效应记忆性CD8 T细胞(terminally differentiated effector memory T cells,Temra)、B细胞、浆细胞,提示可能有更多三级淋巴结构(Tertiary Lymphoid Tissues, TLSs)的形成。而高NI的肿瘤组织中,则有更高丰度的调节性T细胞(Regulatory T cells, Tregs)、炎性巨噬细胞NLRP3+ Macro,以及肌成纤维细胞(myofibroblastic Cancer-Associated Fibroblast, myCAF)。
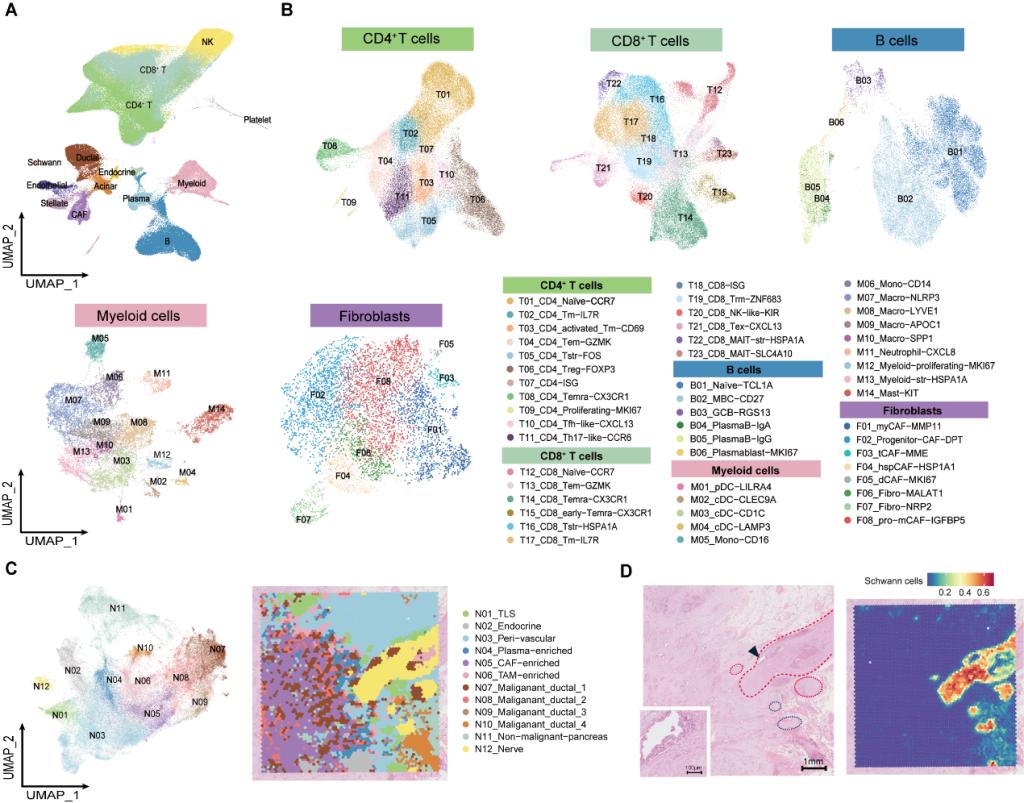
图1 单细胞/空间转录组学整合分析低/高神经侵袭状态的人胰腺导管腺癌(PDAC)组织
那这些细胞(可疑人员)是否真的在神经侵犯位点附近(作案现场)出现呢?研究者结合病理形态学及单细胞投射的空转图谱,鉴定了被侵犯神经束(Invaded Nerves)和未被侵犯神经束(Non-invaded Nerves)附近的细胞组成。结果显示:肿瘤组织中未被侵犯神经束多被TLSs围绕,此区域的成纤维细胞高表达CXCL12趋化因子,可能对CXCR4+B细胞起吸引趋化作用并促进TLSs的形成。而被侵犯神经束附近则少见TLSs,取而代之的是炎性巨噬细胞NLRP3+ Macro及肌成纤维细胞myCAF的聚集,同时此区域还呈现强烈的TGFβ信号。
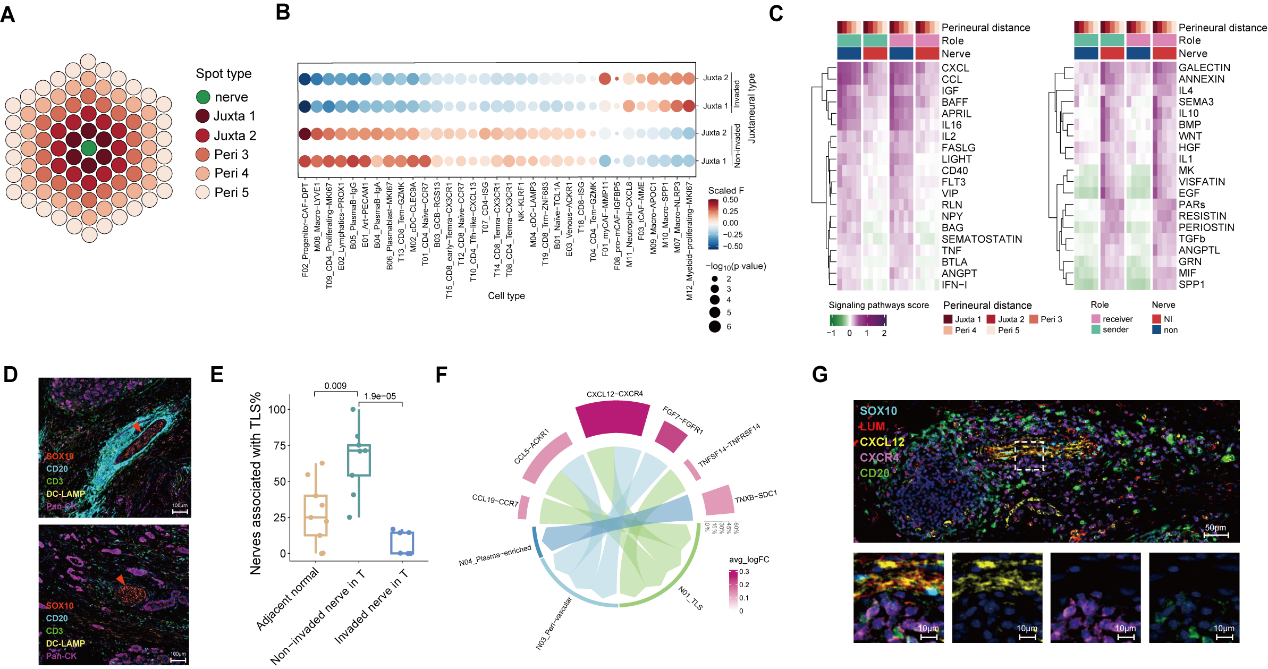
图2 被侵犯神经vs未被侵犯神经周微环境的细胞组成
案发现场除了有这些免疫细胞和基质细胞,毋庸置疑地还存在着事件的主角:癌细胞和神经相关细胞。接下来,研究者进一步解析了神经束中的细胞组构。研究者发现神经束中除了存在常见的髓鞘化施万细胞,还存在一群TGFBI+施万细胞,它们特异性高表达生长因子、胞外基质、及轴突趋化因子,提示其可能同时起到促癌生长、诱导神经趋癌性生长、以及促进神经侵犯的作用。有意思的是,在空间上,它们确实分布在肿瘤侵袭神经的前沿!
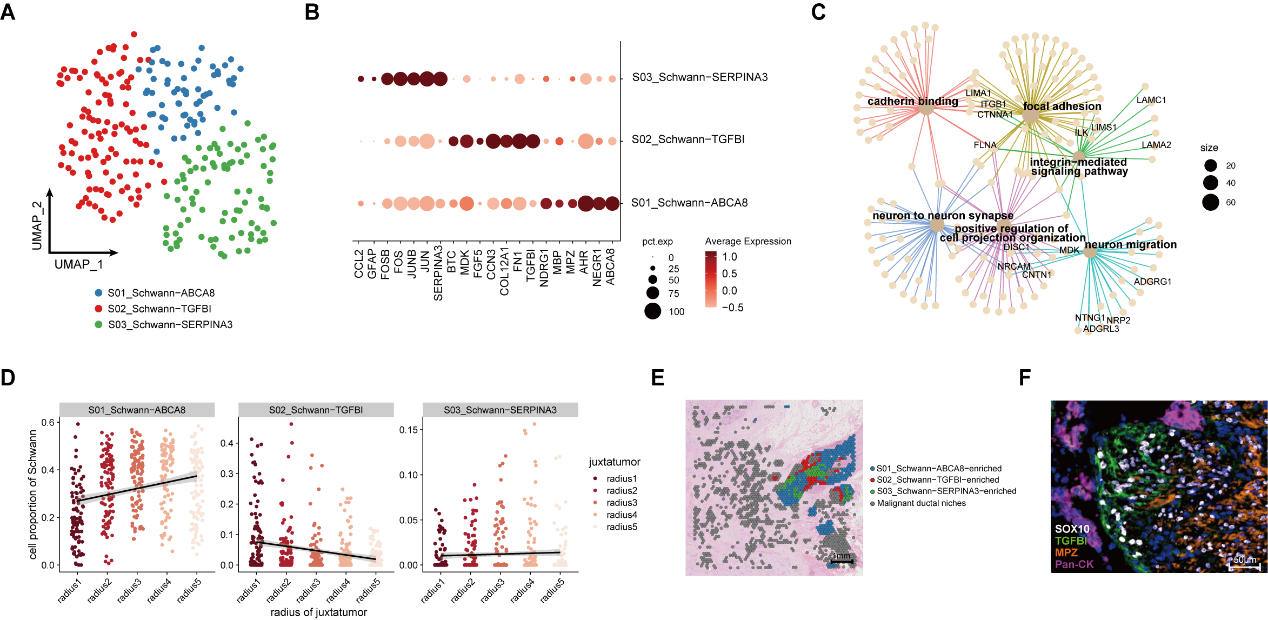
图3 PDAC肿瘤组织中施万细胞亚群特征及其空间分布
那么这群施万细胞受什么因子影响产生,是否具有促癌侵犯的功能呢?研究者分析预测了其接受的细胞因子信号,发现TGFβ1因子名列前茅,且主要来源于NLRP3+ Macro及myCAF。体外实验证明,TGFβ1因子能促使施万细胞向S02_Schwann-TGFBI表型分化。TGFβ1诱导的施万细胞能显著促进胰腺癌肿瘤细胞系的侵袭和迁移。总而言之,研究者发现被侵犯神经束附近存在炎性巨噬细胞NLRP3+ Macro及肌成纤维细胞myCAF富集,它们分泌的TGFβ1因子诱导施万细胞向S02_Schwann-TGFBI表型分化,进一步促进癌细胞侵犯神经。
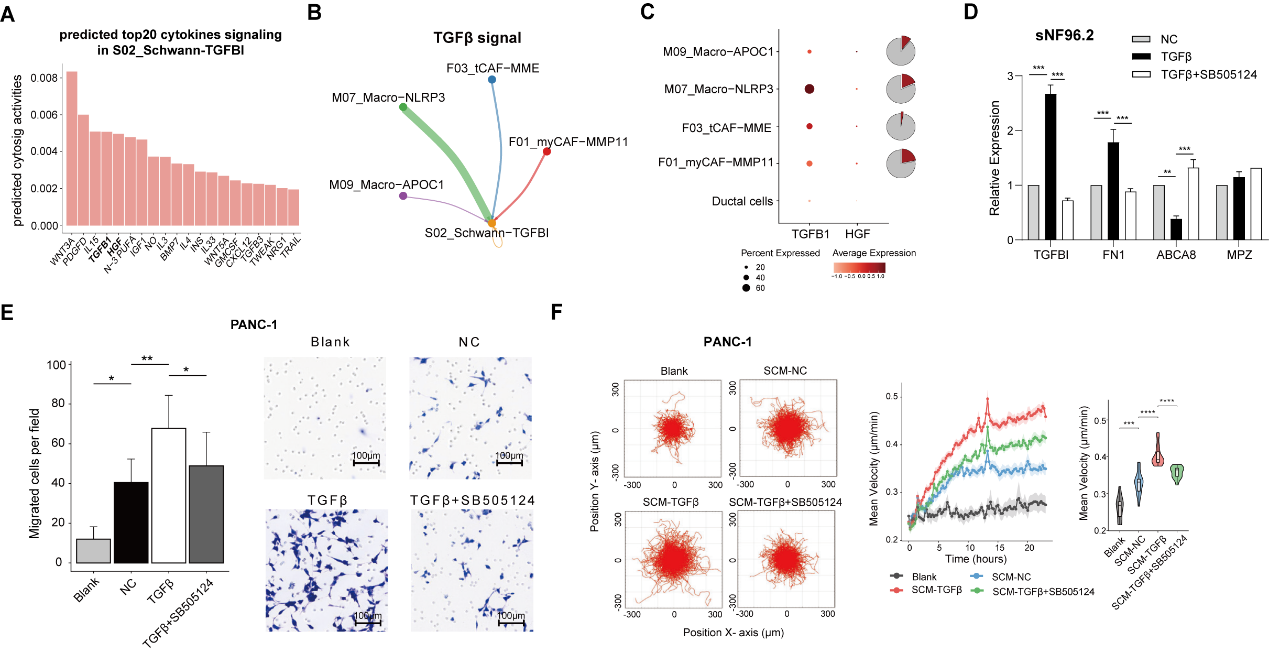
图4 S02_Schwann-TGFBI施万细胞亚群的诱导及功能
另一方面,在对癌细胞的深入解析中,研究者通过创新性地整合单细胞转录组、空间转录组与病理形态学三维证据链,锁定两类具有显著神经侵袭倾向的癌细胞亚群:D09_Ductal-CEACAM6 和 D04_Ductal-GABRP。前者呈现低分化基底样(basal-like)特征及高EMT(上皮-间质转化)活性,后者则高表达神经递质受体,呈现为中分化异形腺体样。尤为重要的是,这些细胞的基因表达特征与病理形态实现跨维度互证。该发现为AI驱动的病理图像分析提供了分子基础——未来仅通过数字化病理切片,或可快速预测肿瘤亚型,指导临床制定针对神经侵袭的精准阻断方案。
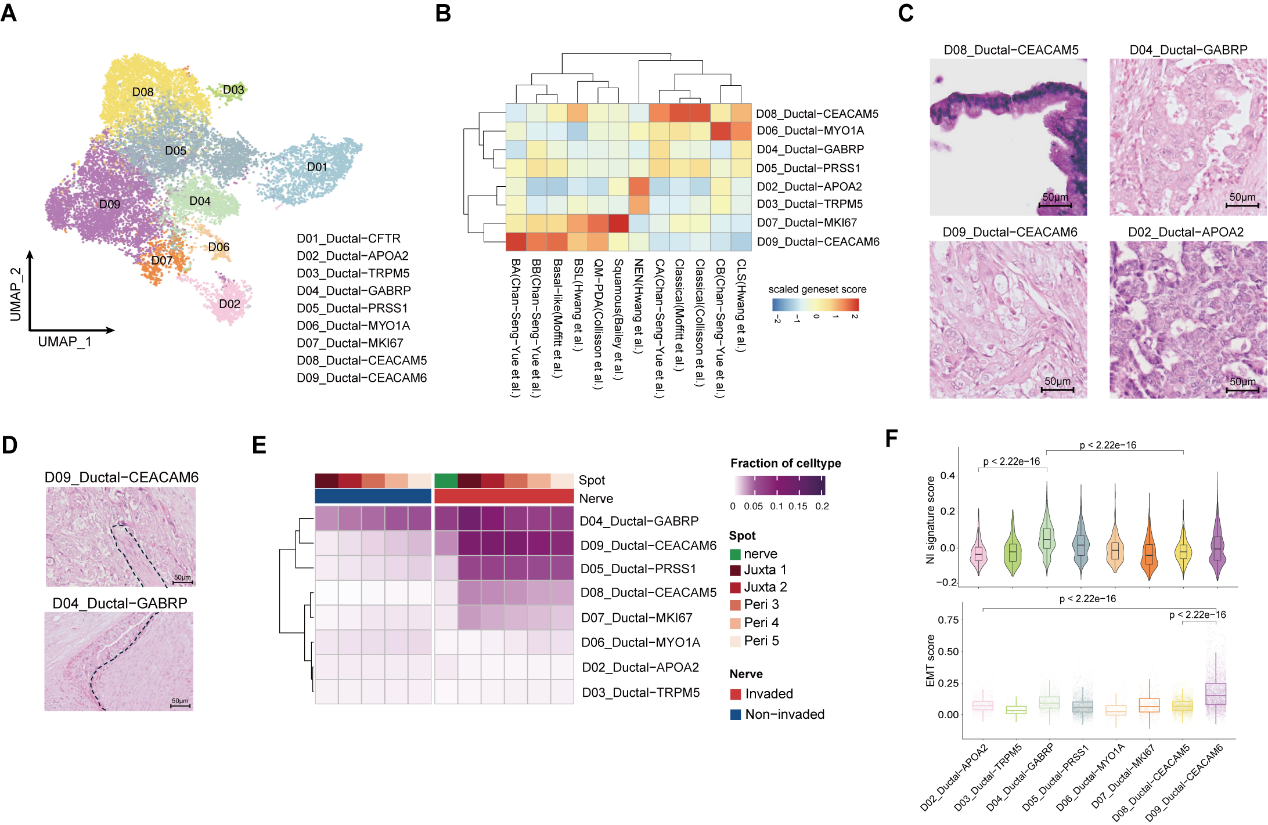
图5 易发生神经侵犯的癌细胞亚类
此研究首次对人肿瘤组织原位神经进行了多组学系统描绘,为日后肿瘤神经生物学的研究提供了宝贵的参考资源。其对肿瘤相关神经束内细胞组成的高分辨率刻画,鉴定出了重要的外周神经相关类群:三类施万细胞、神经内成纤维细胞、神经内组织驻留巨噬细胞、神经损伤修复巨噬细胞等。肿瘤微环境细胞对施万细胞可塑性的调控机制为理解神经-肿瘤互作提供了独特的视角。研究发现肿瘤相关神经束附近存在TLS结构,提示神经支配(Innervation)在调控抗肿瘤免疫中可能起到关键作用。这些开创性的洞察有望激发后续研究,进一步揭示神经系统、免疫组分及癌细胞在肿瘤发生、进展及转移过程中的相互作用机制。
深圳湾实验室副研究员陈敏敏、北京大学生物医学前沿创新中心/昌平实验室博士生高沁航、深圳湾实验室博士后宁慧恒、研究助理陈康、助理研究员高洋,广东省人民医院余敏医师、刘超群博士为本论文共同第一作者。重庆医科大学/北京大学生物医学前沿创新中心张泽民教授、广东省人民医院陈汝福、张庆玲教授、深圳湾实验室陈敏敏副研究员为论文共同通讯作者。此研究得到了深圳湾实验室重大项目、国家重点研发计划、国家自然科学基金、深圳湾实验室开放基金等多项基金的支持。
论文标题:
Integrated Single-Cell and Spatial Transcriptomics Uncover Distinct Cellular Subtypes Involved in Neural Invasion inPancreatic Cancer
供稿|张泽民课题组
编辑|鲍 鲍
责编|远 山
欢迎投稿、建议|media@szbl.ac.cn

 粤公网安备44031102000926号
粤公网安备44031102000926号