近日,深圳湾实验室传染病研究所与中国科学院微生物研究所联合研究团队在 Cell Reports 杂志发表题为“Delicate regulation of IL-1β-mediated inflammationby cyclophilin A”的学术论文。该研究揭示了宿主蛋白Cyclophilin A(CypA)在炎症不同阶段对IL-1β介导炎症的调控机制,有助于深入理解炎症反应的复杂且精细的调控过程,并为抗炎症药物研究及IL-1β相关的炎症和肿瘤等疾病的治疗提供了重要理论支撑。
炎症是机体对病原微生物、有害刺激物或物理伤害所产生的防御反应。适度的炎症有利于清除病原微生物和修复受损组织,但过度的炎症会导致进一步的组织受损甚至危害生命。炎症一般可分为炎症激活、炎症消退以及组织修复、稳态重构三个阶段,细胞因子、趋化因子等炎性介质在炎症的不同阶段发挥着不同的作用。IL-1β是典型的促炎细胞因子,其表达受到双信号的严格控制。起始信号可以诱导无生物活性pro-IL-1β的表达,激活信号则能够激活炎症小体,随后成熟的Caspase-1将 pro-IL-1β切割成有生物活性的IL-1β并分泌到细胞外发挥作用。
该研究利用LPS诱导小鼠急性肺炎的模型,发现CypA在炎症早期能够促进炎症,而在炎症后期却发挥了抑制炎症的作用,这与CypA调控的IL-1β的产生密切相关。在炎症激活阶段,CypA增强pro-IL-1β的K63连接泛素化,进而有利于IL-1β的成熟。而在炎症消退阶段,CypA增强pro-IL-1β的K48连接泛素化及蛋白酶体途径降解。成熟的IL-1β与其受体结合后激活NF-κB、c-Jun等转录因子,触发炎症级联反应。研究人员进一步构建了IL-1β诱导炎症的小鼠和细胞模型,发现CypA能够增强促炎细胞因子的表达,加重肺组织损伤。同时,CypA抑制ILK去K63连接泛素化,从而通过正调控IL-1β/ILK/AKT信号通路促进肺上皮细胞间质化介导的肺纤维化修复。综上,CypA通过增强IL-1β的表达和成熟促进炎症的激活和肺损伤,随后通过增强IL-1β的降解和IL-1β诱导的上皮细胞间质化促进炎症的消退和肺组织修复。
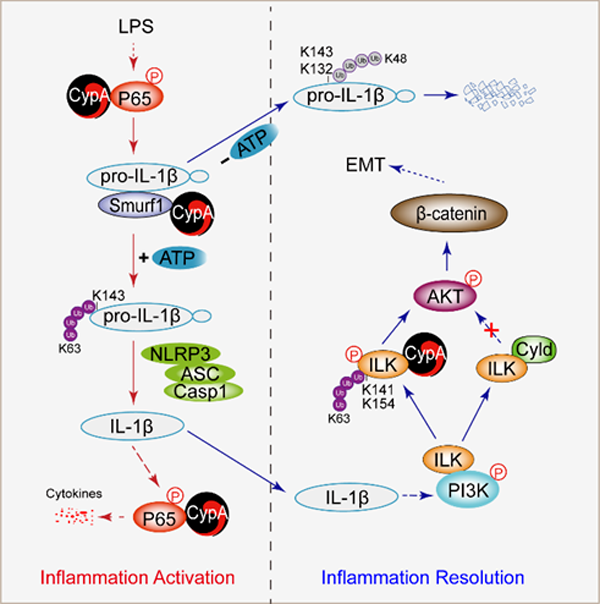
CypA在炎症不同阶段对IL-1β介导炎症的精确调控模式图
刘文军研究员、孙蕾项目研究员为本论文共同通讯作者,杨文贤博士为论文第一作者。该研究得到中国科学院战略性先导科技专项(B类)、国家自然科学基金委、深圳湾实验室等资助。
原文信息:
Delicate regulation of IL-1β-mediated inflammation by cyclophilin A
供稿 | 传染病研究所
编辑 | 鲍 啦
欢迎投稿、建议 | media@szbl.ac.cn