近日,深圳湾实验室肿瘤研究所张泽民团队与合作者在国际知名学术期刊英国胃肠病学会杂志GUT上在线发表了题为“Single-cell RNA sequencing reveals intrahepatic and peripheral immune characteristics related to disease phases in HBV-infected patients”的研究论文,深圳湾实验室博士后李杰圣为该文并列第一作者。该研究系统解析了乙肝病毒不同感染阶段的免疫反应特征,揭示乙肝病毒免疫发病新机制。
我国乙型肝炎病毒(Hepatitis B Virus, HBV)携带者约有7000万例,其中慢性乙型肝炎(Chronic Hepatitis B,CHB)患者约2000万~3000万例[1]。目前,临床上用于CHB治疗的药物主要包括干扰素和核苷(酸)类似物(NAs),抗病毒治疗能够有效抑制病毒复制,降低HBV相关肝硬化、肝癌的发生风险。但仅极少数患者可以实现“功能性治愈”,即达到乙肝表面抗原(Hepatitis B surface antigen, HBsAg)转阴。大量CHB患者需长期乃至终身抗病毒治疗,极大降低了患者的生活质量并造成沉重负担。
大部分成年人感染HBV后可以自愈,在围产期和婴幼儿时期发生的HBV感染,分别有90%和25%~30%将发展成CHB。根据抗原及血清学特点,CHB可进一步分为免疫耐受期、免疫活化期、免疫控制期和再活动期。急性HBV感染过程中,病毒的清除主要依赖于机体的免疫系统。在CHB患者中,病毒持续复制、病毒抗原大量存在并伴随免疫功能紊乱。受限于肝脏样本可及性及传统研究技术手段,既往HBV感染相关临床转化研究大多使用外周血样本。而基于动物模型及少量包含患者肝组织取样的研究显示,肝脏原位的抗HBV免疫应答与外周存在很大差异,且对疾病转归更为关键[2]。因此,系统解析HBV感染肝脏的免疫特征,阐明不同疾病阶段建立、维持和转化的免疫效应机制,将有助于开发CHB免疫治疗新策略以提高临床治愈率。
近日,解放军总医院第五医学中心王福生院士、北京大学生物医学前沿创新中心(BIOPIC)、肿瘤研究所召集人张泽民资深研究员、任仙文研究员(现工作单位:昌平实验室)合作在GUT上在线发表了题为“Single-cell RNA sequencing reveals intrahepatic and peripheral immune characteristics related to disease phases in HBV-infected patients”的研究论文。在该项研究中,研究人员对来自23个人46个外周血和肝脏配对样本的24.3万个细胞进行单细胞免疫组库测序,首次深度剖析了HBV感染不同阶段的肝脏和外周免疫微环境特点。揭示在HBV慢性感染和急性感染中耗竭T细胞的动态变化特点和免疫细胞互作网络。本研究系统解析了HBV不同感染阶段的免疫反应特征,揭示HBV免疫发病新机制。
研究入组乙肝感染不同阶段患者(包括免疫耐受期—IT,n=6;免疫活化期—IA,n=5;急性感染恢复期—AR,n=3;慢性感染治愈患者—CR,n=3)和健康肝移植供者(HC,n=6)作为对照。留取入组对象外周血和肝穿组织,流式分选富集CD45+免疫细胞,利用10X Genomics单细胞测序平台进行单细胞转录组、TCR、BCR分析。研究共纳入来自23个人的46个样本,得到24.3万个免疫细胞单细胞转录组。解析了CD8+ T、CD4+ T、NK、T、B、髓系细胞等8个主要免疫细胞群和60个亚群的转录特征及变化特点。
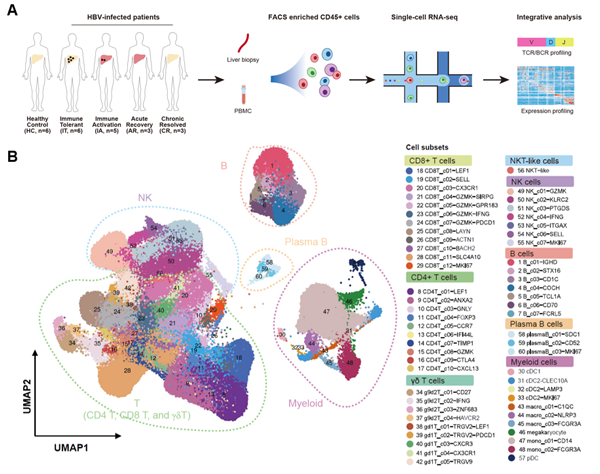
图1. 研究设计
根据转录组特征,CD8+ T细胞可进一步分为12个亚群,包括在外周血中富集的初始(c01-LEF1)、效应(c03-CX3CR1)亚群和在肝脏中富集的耗竭(c08-LAYN)、MAIT (c11-SLC4A10)亚群等。通过比较CD8+ T细胞在不同分组间的变化特点,发现相较于HC组,耗竭CD8+ T细胞(Tex)在IT、IA和AR组肝脏中增多,其中IA和AR的增加幅度更大且呈现更显著的耗竭相关转录特征。进一步通过基于TCR追踪的STARTRAC算法[3]对CD8+ T细胞的动态特点(包括克隆扩增、表型转换及组织间迁移)进行分析,IA和AR两组间呈现显著差异。其中IA组耗竭CD8+ T细胞主要来自于自身克隆扩增;而AR组耗竭CD8+ T细胞更多来自外周效应T细胞的浸润和转化。同时发现,患者外周血一群CX3CR1+ 中心记忆CD8+ T(Tcm)细胞亚群的频率,具有预测HBV清除的潜在应用价值。
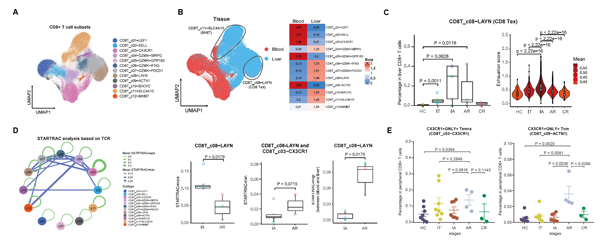
图2. CD8+ T细胞特征
对CD4+ T细胞和髓系细胞的分析发现,肝脏驻留的调节性CD4+ T细胞(Treg, CD4T_c09-CTLA4)在慢性感染期患者(IT和IA)肝脏中富集,调节性巨噬细胞(Mreg, macro_c03-FCGR3A)在IT期富集。通过CSOmap算法[4]对细胞的空间互作关系进行分析发现,在慢性感染期患者肝组织中,特异性存在Treg-Tex-Mreg的互作网络。并通过多色免疫组化对生信发现进行验证,确定了慢性感染期患者肝脏三群细胞的空间邻近关系并鉴定Tex细胞上HLA-I类分子和Mreg上白细胞免疫球蛋白样受体 (LILR)是潜在的互作效应信号。
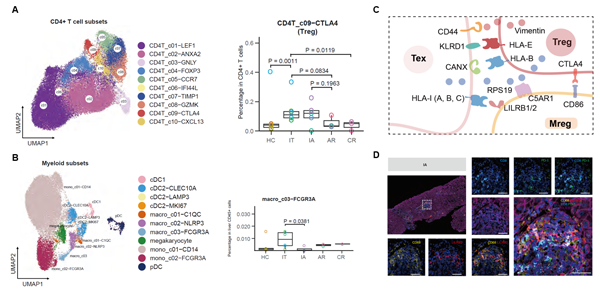
图3. CHB患者肝组织中Tex与Treg和Mreg的互作
研究人员对患者免疫特征和临床指标的关系进行分析,发现肝脏髓系细胞组分的改变与患者血浆HBV DNA和HBsAg水平相关,而患者间T细胞组分的异质性主要与血浆转氨酶水平、肝组织病理炎症分期相关。这些发现提示病毒抗原或直接诱导的天然免疫细胞的改变,而T细胞的功能紊乱与患者的肝组织损伤程度密切相关。
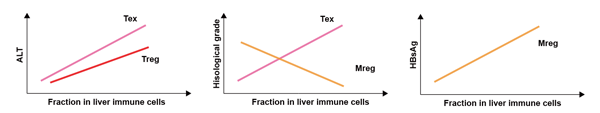
图4. 免疫特征与临床指标的关联
综上,本研究提供了一个全面的单细胞免疫组图谱来描述HBV感染患者不同阶段肝脏和外周的免疫特征。IT患者的特点是肝脏中Treg、Tex细胞增加。这些变化在IA患者中更加明显,并与肝脏损伤程度相关。Treg-Tex-Mreg在IT和IA期表现出强相互作用。这种免疫细胞互作网络可能促进HBV持续感染及肝组织病变。急性HBV感染中也表现Tex增多,但与IA相比其来源不同。此外,外周血CX3CR1+Tcm细胞可作为一个预测病毒清除的免疫指标。这些发现为理解HBV感染的免疫机制迈出了重要的一步,将有助于开发更有效的治疗靶点和CHB患者的免疫治疗的生物标志物。
解放军总医院第五医学中心张超副研究员、程勇前副主任医师,北京大学BIOPIC博士生李杰圣(现工作单位:深圳湾实验室)为该论文的并列第一作者,解放军总医院第五医学中心王福生院士、北京大学BIOPIC、肿瘤研究所召集人/资深研究员张泽民、北京大学BIOPIC任仙文研究员(现工作单位:昌平实验室)为该论文的共同通讯作者。该课题得到了自然科学基金和重点研发计划项目的资助。
参考文献
[1] 王贵强, 段钟平, 王福生, 等. 慢性乙型肝炎防治指南 (2019 年版)[J]. 中国病毒病杂志, 2020, 10(1): 1-25.
[2] Gill U S, Pallett L J, Thomas N, et al. Fine needle aspirates comprehensively sample intrahepatic immunity[J]. Gut, 2019, 68(8): 1493-1503.
[3] Zhang L, Yu X, Zheng L, et al. Lineage tracking reveals dynamic relationships of T cells in colorectal cancer[J]. Nature, 2018, 564(7735): 268-272.
[4] Ren X, Zhong G, Zhang Q, et al. Reconstruction of cell spatial organization from single-cell RNA sequencing data based on ligand-receptor mediated self-assembly[J]. Cell research, 2020, 30(9): 763-778.
原文信息:
文章来源 | 张泽民课题组
编辑 | 鲍 啦
欢迎投稿、建议 | media@szbl.ac.cn