近日,深圳湾实验室坪山生物医药研发转化中心(以下简称“坪山中心”)|北京大学深圳研究生院(以下简称“北大深研院”)李子刚/尹丰课题组开发了一种基于吡啶盐的多肽/蛋白质可逆化学修饰方法学。该成果已发表在J. Am. Chem. Soc. 上,标题为“Traceless Peptide and Protein Modification via Rational Tuning of Pyridiniums”。
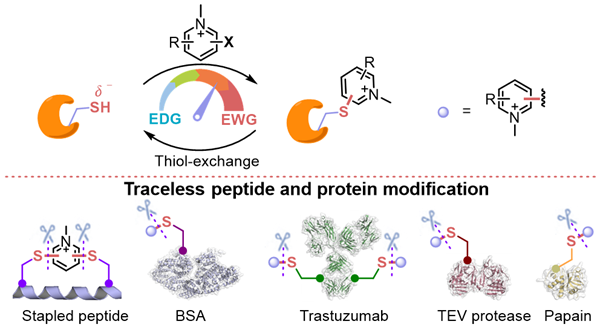
多肽和蛋白质的化学修饰方法学在化学生物学研究中扮演着关键角色。近年来,可逆的生物偶联化学方法迅速崛起,成为在离体、体内和活体系统中进行生物分子功能研究和发挥生物医学功能等方面的强大工具。尽管传统的生物偶联化学已经广泛用于生物分子的标记、追踪和捕获,但新近发展的可逆或可裂解的生物偶联反应为在生物系统中重新生成小分子和各类生物大分子提供了新的可能性,允许在体内外对生物过程进行时间和空间上的多维调控。
李子刚/尹丰课题组以前期工作为基础,成功地开发了一系列独特的基于缺电子的正电性化合物,如锍盐和吡啶盐类化合物,用于多肽/蛋白质的化学修饰。这些方法已成功应用于化学蛋白组学、多肽固相合成、环化多肽调节剂、多肽偶联药物(PDC)、共价PROTAC等研究领域1-10。最新研究中,课题组基于对可逆/可裂解的化学生物学工具的需求,从缺电子的芳香亲核取代反应(SNAr)体系的研究中,发现了巯基-吡啶盐加合物具有的硫醇交换反应活性。此外,他们建立了巯基-吡啶盐硫醇交换反应的反应速率常数与吡啶盐取代基Hammett常数的线性关系,明确了取代基的吸电子性/给电子性与其硫醇交换反应活性的关联性,实现了对吡啶盐偶联产物可裂解性的理性调节。
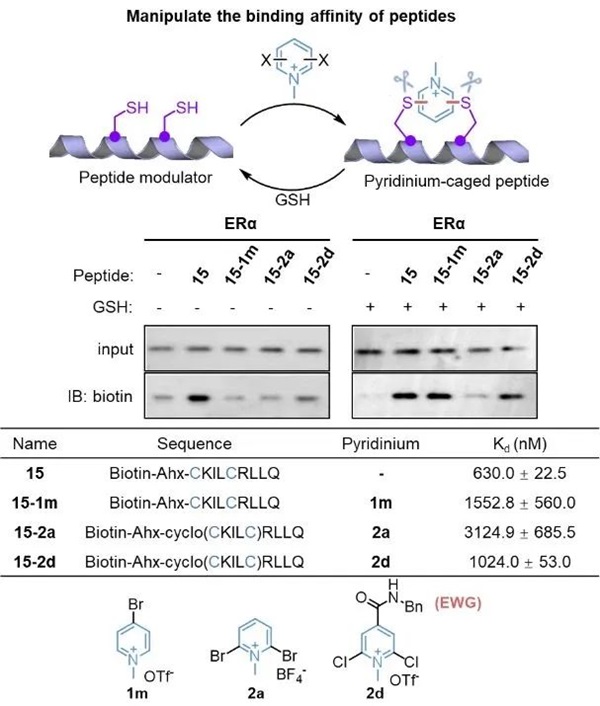
卤代吡啶类化合物的结构多样性为其在进一步的化学生物学应用中提供了广泛的前景。首先,李子刚/尹丰课题组建立了基于吡啶盐的可逆多肽环化方法,并成功通过该方法实现了多肽-蛋白亲和力的可逆调控,以及多肽穿膜性和稳定性的改善。其次,基于卤代吡啶盐的蛋白质层面的偶联反应具有高效和高半胱氨酸选择性的特点,而GSH响应性的解偶联也具有较好的应用潜力。例如,他们验证了吡啶盐在抗体偶联药物(ADC)的可裂解连接子中的应用以及Cys蛋白酶活的可逆抑制等。最后,通过对吡啶盐反应体系的深入了解,还可以快速设计系列ABPP探针,为基于SNAr的新共价化学类型的开发提供更多可能性。
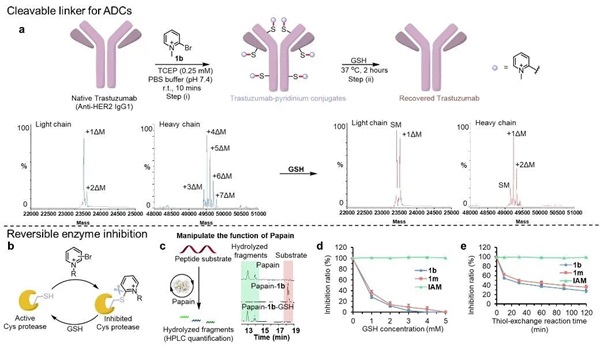
综上所述,基于吡啶盐的可逆多肽和蛋白质化学修饰方法有望成为化学生物学和生物医学领域的潜在研究工具,而在SNAr体系上可裂解性的有序调节的理念也在更广泛的生物场景中具有应用前景。
深圳技术大学万川副研究员和北大深研院博士生章亦驰为论文共同第一作者,坪山中心尹丰研究员、王蕊博士和坪山中心/北大深研院李子刚教授为该论文共同通讯作者。该工作还得到了坪山中心的罗钦宏博士、刘建博、叶宇鑫博士和刘志宏博士等人的支持和帮助。该研究得到了国家科技部、国家自然科学基金、广东自然科学基金、深圳市科技创新委员会等基金的支持。
参考文献
1. Shi, X.; Zhao, R.; Jiang, Y.; Zhao, H.; Tian, Y.; Jiang, Y.; Li, J.; Qin, W.; Yin, F.; Li, Z., Reversible stapling of unprotected peptides via chemoselective methionine bis-alkylation/dealkylation. Chem. Sci. 2018, 9 (12), 3227-3232.
2. Wang, D.; Yu, M.; Liu, N.; Lian, C.; Hou, Z.; Wang, R.; Zhao, R.; Li, W.; Jiang, Y.; Shi, X.; Li, S.; Yin, F.; Li, Z., A sulfonium tethered peptide ligand rapidly and selectively modifies protein cysteine in vicinity. Chem. Sci. 2019, 10 (19), 4966-4972.
3. Wang, R.; Yang, D.; Tian, T.; An, Y.; Wan, C.; Chang, Q.; Liang, M.; Hou, Z.; Wang, Y.; Zhang, L.; Li, Z., Low-Toxicity Sulfonium-Based Probes for Cysteine-Specific Profiling in Live Cells. Anal. Chem. 2022, 94 (10), 4366-4372.
4. Wang, Y. N.; Zhao, R. T.; Wan, C.; Kang, W.; Wang, R.; Chiang, C. Y.; Guo, X. C.; Chang, Q.; Hou, Z. F.; Ye, Y. X.; Luo, Q. H.; Zhou, Z. Y.; Liu, J. B.; Li, S. M.; Wang, D. Y.; Yin, F.; Li, Z. G., A proximity-triggered strategy toward transferable proteolysis targeting chimeras. CCS Chem. 2022, 5, 1433-1442.
5. Liu, N.; Zhang, Y.; Lei, Y.; Wang, R.; Zhan, M.; Liu, J.; An, Y.; Zhou, Y.; Zhan, J.; Yin, F.; Li, Z., Design and Evaluation of a Novel Peptide-Drug Conjugate Covalently Targeting SARS-CoV-2 Papain-like Protease. J. Med. Chem. 2022, 65 (1), 876-884.
6. Qin, X.; Wang, R.; Xu, H.; Tu, L.; Chen, H.; Li, H.; Liu, N.; Wang, J.; Li, S.; Yin, F.; Xu, N.; Li, Z., Identification of an autoinhibitory, mitophagy-inducing peptide derived from the transmembrane domain of USP30. Autophagy 2022, 18 (9), 2178-2197.
7. Zhang, Y.; Xu, H.; Jiang, L.; Liu, Z.; Lian, C.; Ding, X.; Wan, C.; Liu, N.; Wang, Y.; Yu, Z.; Zhu, L.; Yin, F.; Li, Z., Sulfonium-Driven Neoantigen-Released DNA Nanodevice as a Precise Vaccine for Tumor Immunotherapy and Prevention. ACS Nano 2022, 16 (11), 19509-19522.
8. Wan, C.; Hou, Z.; Yang, D.; Zhou, Z.; Xu, H.; Wang, Y.; Dai, C.; Liang, M.; Meng, J.; Chen, J.; Yin, F.; Wang, R.; Li, Z., The thiol-sulfoxonium ylide photo-click reaction for bioconjugation. Chem. Sci. 2023, 14 (3), 604-612.
9. Hou, Z.; Wan, C.; Xing, Y.; Guo, X.; Zhang, Y.; Wang, R.; Yin, F.; Li, Z., Bioorthogonal fluoride-responsive azide and alkynyl pyridinium click cycloaddition in vitro and in live cells. Org. Lett. 2023, 25 (23), 4323-4328.
10. Zhong, W.; Wan, C.; Zhou, Z.; Dai, C.; Zhang, Y.; Lu, F.; Yin, F.; Li, Z., 4-Iodine N-Methylpyridinium-Mediated Peptide Synthesis. Org. Lett. 2023, 25 (48), 8661-8665.
原文信息:
Traceless Peptide and Protein Modification via Rational Tuning of Pyridiniums
来源 | 坪山中心
欢迎投稿、建议 | media@szbl.ac.cn